dipropionato de beclometasona 200 mcg
fumarato de formoterol 6 mcg
Solução Aerossol

Bula Profissional de Saúde
IDENTIFICAÇÃO DO MEDICAMENTO
FOSTAIR® 200/6
dipropionato de beclometasona 200 mcg
fumarato de formoterol 6 mcg
APRESENTAÇÕES
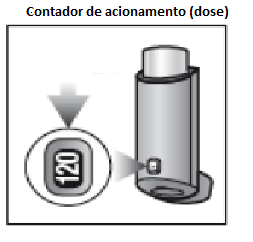
Solução aerossol. Frasco contendo 120 acionamentos (doses), acompanhado de bocal (dispositivo para aplicação oral em forma de L), com contador de acionamento (dose).
Cada acionamento (dose) contém 200 mcg de dipropionato de beclometasona e 6 mcg de fumarato de formoterol.
USO INALATÓRIO POR VIA ORAL
USO ADULTO
COMPOSIÇÃO:
Cada acionamento (dose) de FOSTAIR® contém:
|
dipropionato de beclometasona............................................... |
200 mcg |
|
fumarato de formoterol (na forma de fumarato de formoterol di-hidratado)........................................................................... |
6 mcg |
|
Excipiente qsp........................................................................ |
1 acionamento (dose) |
Excipientes: ácido clorídrico, álcool etílico e norflurano (HFA-134a).
O produto não contém substâncias prejudiciais para a camada de ozônio.
Atenção: em cada acionamento (dose), a dose medida de 200 mcg de dipropionato de beclometasona equivale a dose liberada de 177,7 mcg e a dose medida de 6 mcg de fumarato de formoterol equivale a dose liberada de 5,1 mcg.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE
FOSTAIR® é indicado no tratamento regular da asma, no qual o uso de uma combinação fixa (broncodilatador de longa ação β-2-agonista e corticosteroide inalatório) é considerado adequado:
- Pacientes não controlados adequadamente através de inalação de corticosteroides e agonistas β-2 de ação rápida, quando necessário, ou
- Pacientes controlados adequadamente com inalação de corticosteroides e agonista β-2 de ação prolongada.
FOSTAIR® não é indicado para o tratamento inicial da asma.
Não há dados clínicos relevantes sobre o uso de FOSTAIR® 200/6 no tratamento de ataques agudos de asma.
2.1 Dados de Segurança Pré-Clínica:
Dados não clínicos dos componentes individuais de FOSTAIR® não mostraram risco para humanos, baseado nos estudos convencionais de segurança farmacológica e de toxicidade de dose repetida. O perfil de toxicidade da combinação refletiu os de toxicidade dos componentes separados sem aumento na toxicidade ou de achados inesperados.
Eles estão relacionados à atividade imunossupressora do dipropionato de beclometasona e aos efeitos cardiovasculares conhecidos do formoterol, evidentes principalmente em cães. Não foram observadas elevações da toxicidade ou ocorrência de achados inesperados.
Estudos sobre a reprodução em ratos mostrou efeitos dependentes de dose. A presença de altas doses de dipropionato de beclometasona foi associada com a redução na fertilidade das fêmeas, diminuição no número de implantações e toxicidade embrio-fetal. Sabe-se que altas doses de corticosteroides em animais prenhes causam anormalidades no desenvolvimento fetal incluindo fenda palatal e crescimento intrauterino diminuído, e é provável que os efeitos observados com o uso da combinação dipropionato de beclometasona/formoterol sejam em função do dipropionato de beclometasona. Estes efeitos foram observados apenas com exposição sistêmica elevada ao metabólito ativo B-17-MP (beclometasona 17-monopropionato), mais de 200 vezes dos níveis séricos esperados em pacientes. Além disso, aumento na duração da gestação e do parto, atribuído ao efeito tocolítico do β-2-simpatomimético foi visto em estudos com animais. Estes efeitos foram observados quando o nível sérico materno de formoterol era menor que o nível esperado em pacientes tratados com FOSTAIR®.
Estudos de genotoxicidade realizados com uma combinação de dipropionato de beclometasona/formoterol não indicam potencial mutagênico. Não foram realizados estudos de oncogenicidade com FOSTAIR®. Contudo, não foi evidenciado potencial de mutagenicidade com a combinação, e os dados relatados por indivíduos não sugerem qualquer risco potencial de oncogenicidade em homens.
Os dados pré-clínicos sobre o propelente norflurano (HFA-134a) não revelaram riscos especiais para o ser humano, segundo estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, genotoxicidade, potencial carcinogênico e toxicidade reprodutiva.
A eficácia de FOSTAIR® 200/ 6 (solução aerossol), 2 acionamentos (doses) duas vezes por dia, foi avaliada em um estudo clínico pivotal de 12 semanas comparando o efeito sobre a função pulmonar versus tratamento monoterápico com dipriopionato beclometasona em pacientes com asma não controlada adequadamente com o tratamento anterior (alta dose de ICS ou média dose de combinaçãos de ICS + LABAs). O estudo demonstrou a superioridade de FOSTAIR® 200/6 em comparação com dipropionato de beclometasona HFA em termos de mudança da linha basal na pré-dose média PFE matinal (diferença média ajustada de 18,53 L).1
Em um estudo clínico pivotal de 24 semanas, o perfil de segurança de FOSTAIR® 200/6, 2 acionamentos (doses) duas vezes por dia, foi comparável a de uma combinação de dose fixa aprovada de fluticasona/salmeterol 500/50, 1 acionamento (dose) duas vezes ao dia. Nenhum efeito clinicamente relevante foi observado com o FOSTAIR® 200/6 no eixo hipotálamo-pituitária-adrenal (HPA) após 6 meses de tratamento. Esse estudo mostrou que FOSTAIR® 200/6 e a outra associação de dose fixa aprovada não foram superiores à monoterapia com dipropionato de beclometasona não extrafina (2.000 mcg/dia) sobre a mudança de VEF1 pré-dose matinal e na porcentagem de dias completos sem sintomas de asma.1
Referência:
Mecanismos de Ação e Efeitos Farmacodinâmicos:
FOSTAIR® contém dipropionato de beclometasona e formoterol, na forma de solução aerossol (solução pressurizada contendo o gás HFA). Estes dois princípios ativos têm diferentes modos de ação. Assim como ocorre com outras combinações inalatórias de corticosteroides e agonistas beta-2, efeitos aditivos foram observados em relação à redução da exacerbação da asma.
Os mecanismos de ação das duas substâncias são discutidos a seguir.
O dipropionato de beclometasona, administrado por inalação e em doses recomendadas, apresenta ação anti-inflamatória nos pulmões, resultando em redução dos sintomas e exacerbações da asma, com menos efeitos adversos do que corticosteroides administrados por via sistêmica.
Formoterol é um agonista β-2-adrenérgico seletivo que produz relaxamento do músculo liso brônquico em pacientes com obstrução reversível das vias aéreas. O efeito broncodilatador surge rapidamente, em 1-3 minutos após a inalação, e dura 12 horas após uma única administração.
Propriedades Farmacocinéticas:
A exposição sistêmica aos princípios ativos dipropionato de beclometasona e formoterol, na combinação fixa do FOSTAIR®, foi comparada à exposição sistêmica dos componentes isolados em estudo clínico.
Em um estudo farmacocinético realizado em indivíduos saudáveis tratados com uma dose única de FOSTAIR® combinação de dose fixa com [4 acionamentos (doses) de 100/6 microgramas] ou uma dose única de dipropionato de beclometasona CFC [4 acionamentos (doses) de 250 microgramas em sequência] e formoterol HFA [4 acionamentos (doses) de 6 microgramas em sequência], a área sob a curva (ASC) do principal metabólito ativo do dipropionato de beclometasona (beclometasona-17-monopropionato) e a sua concentração plasmática máxima, foram, respectivamente, 35% e 19% mais baixas com a combinação de dose fixa do que com a formulação com partículas não extrafinas de dipropionato de beclometasona CFC. A taxa de absorção foi mais rápida (0,5 versus 2h) com a combinação de dose fixa em comparação com a formulação de partículas não extrafinas de dipropionato de beclometasona CFC na forma isolada. Em relação ao formoterol, a concentração plasmática máxima foi semelhante após a administração da combinação de dose fixa ou da extemporânea e a exposição sistêmica foi ligeiramente mais elevada após a administração de FOSTAIR® do que com a combinação extemporânea.
Não houve evidência de interações farmacocinética ou farmacodinâmica entre o dipropionato de beclometasona e o formoterol.
Um estudo farmacocinético realizado em voluntários saudáveis com bloqueio de carvão ativado demonstrou que a biodisponibilidade pulmonar da beclometasona-17-monopropionato na formulação de FOSTAIR® 200/6 é dose-proporcional à formulação de FOSTAIR® 100/6 para ASC somente {taxa média entre as biodisponibilidades sistêmicas da formulação de 200/6 e 100/6 igual a 91,63 (intervalo de confiança de 90%: 83,79; 100,20)}. Para o formoterol, a taxa média entre a biodisponibilidade sistêmica na formulação de 200/6 e 100/6 foi igual a 86,15 (intervalo de confiança de 90%: 75,94; 97,74).
Em outro estudo farmacocinético realizado em voluntários saudáveis, sem bloqueio de carvão ativado, a exposição sistêmica da beclometasona-17-monopropionato na formulação de FOSTAIR® 200/6 mostrou ser dose-proporcional à formulação de FOSTAIR® 100/6{taxa média entre as biodisponibilidades sistêmicas na formulação de 200/6 e 100/6 igual a 89,2 (Intervalo de confiança de 90%: 79,8; 99,7)}. A exposição sistêmica total de fumarato de formoterol permaneceu inalterada {taxa média entre as biodisponibilidades sistêmicas na formulação de 200/6 e 100/6 igual a 102,2 (Intervalo de confiança de 90%: 90,4; 115,5)}.
O uso de FOSTAIR® 200/6 com o espaçador Aerochamber Plus® em voluntários saudáveis aumentou a deposição pulmonar do metabólito ativo do dipropionato de beclometasona, a beclometasona-17-monopropionato, e do formoterol em 25% e 32%, respectivamente, enquanto que a exposição sistêmica total foi ligeiramente reduzida para a beclometasona-17-monopropionato (em 17%) e formoterol (em 17%), e aumentada para o dipropionato de beclometasona inalterado (em 54%).
Dipropionato de beclometasona
O dipropionato de beclometasona é uma pró-droga, com fraca afinidade de ligação com o receptor de glicocorticoide, que é hidrolisada via enzimas esterases para um metabólito ativo, a beclometasona-17-monopropionato (B-17-MP), com uma atividade anti-inflamatória tópica mais potente se comparado à pró-droga (dipropionato de beclometasona).
Absorção, distribuição e biotransformação:
O dipropionato de beclometasona inalado é rapidamente absorvido pelos pulmões; antes da absorção há uma ampla conversão do dipropionato de beclometasona em seu metabólito ativo, a beclometasona-17-monopropionato (B-17-MP), via enzimas esterases que são encontradas na maioria dos tecidos. A biodisponibilidade sistêmica do metabólito ativo é decorrente da absorção a partir do pulmão (36%) e da absorção gastrintestinal da dose deglutida.
A biodisponibilidade do dipropionato de beclometasona deglutido é desprezível, mas a conversão pré-sistêmica para B-17-MP resulta em 41% de absorção como metabólito ativo (B-17-MP). Há um aumento aproximadamente linear na exposição sistêmica com o aumento da dose inalada. A biodisponibilidade absoluta após a inalação é de aproximadamente 2% e 62% da dose nominal para o dipropionato de beclometasona inalterado e B-17-MP, respectivamente. Após a administração intravenosa, a disposição de dipropionato de beclometasona e B-17-MP se caracteriza por alta depuração plasmática (150 e 120L/h respectivamente), com pequeno volume de distribuição em estado de equilíbrio para dipropionato de beclometasona (20L) e ampla distribuição tecidual para B-17-MP (424L). A disposição metabólica do dipropionato de beclometasona (82%) resulta principalmente em seu metabólito ativo (B-17-MP). A ligação proteica plasmática é moderadamente elevada (87%).
Eliminação:
A excreção fecal é a principal via de eliminação do dipropionato de beclometasona, principalmente como metabólitos polares. A excreção renal de dipropionato de beclometasona e seus metabólitos são desprezíveis. As meias-vidas de eliminação terminal são 0,5h e 2,7 h para dipropionato de beclometasona e B-17-MP, respectivamente.
Populações especiais:
A farmacocinética do dipropionato de beclometasona em pacientes com comprometimento renal ou hepático não foi estudada. Entretanto, uma vez que o dipropionato de beclometasona é metabolizado muito rapidamente via enzimas esterases (presentes no líquido intestinal, soro, pulmões e fígado) para originar produtos mais polares (beclometasona-21-monopropionato, beclometasona-17-monopropionato e beclometasona álcool), é pouco provável que o comprometimento hepático modifique o perfil de segurança e a farmacocinética do dipropionato de beclometasona. Uma vez que o dipropionato de beclometasona ou seus metabólitos não foram observados na urina, uma elevação na exposição sistêmica não foi verificada em pacientes com comprometimento renal.
Formoterol
Absorção, distribuição e biotransformação:
Após a inalação, o formoterol é absorvido a partir dos pulmões e do trato gastrintestinal. A fração de dose inalada que é deglutida depende do tipo de dispositivo usado e da técnica de inalação: com um pMDI (solução aerossol) pode chegar a 90%, portanto, os dados relacionados à administração oral são relevantes para a via inalatória. No mínimo 65% da fração que é deglutida é absorvida a partir do trato gastrointestinal. O pico da concentração plasmática do medicamento inalterado ocorreu entre 0,5 a 1 hora da administração oral. A ligação proteica plasmática de formoterol foi 61-64% com 34% de ligação com albumina. Não houve saturação de ligação na faixa de concentração atingida com doses terapêuticas. A meia-vida de eliminação determinada após a administração oral foi de 2-3 horas. A absorção de formoterol foi linear após a inalação de 12 a 96 µg de fumarato de formoterol.
O formoterol é amplamente metabolizado e a via proeminente envolve conjugação direta no grupo hidroxila fenólico. O conjugado ácido glicuronídeo é inativo. A segunda principal via envolve a O-desmetilação seguida por conjugação no grupo 2’-hidroxila fenólico. As isoenzimas citocromo P450 CYP2D6, CYP2C19 e CYP2C9 estão envolvidas na O-desmetilação de formoterol. O fígado parece ser o local primário de metabolismo. O formoterol não inibe as enzimas CYP450 em concentrações terapeuticamente relevantes.
Eliminação:
A excreção urinária cumulativa de formoterol após inalação única a partir de um DPI (pó inalatório) aumentou linearmente na faixa de dose 12 – 96 mcg. Em média, 8% e 25% da dose foram excretadas como formoterol inalterado e total, respectivamente.
Com base nas concentrações plasmáticas medidas após a inalação de uma dose única de 120 mcg em 12 voluntários saudáveis, a meia-vida de eliminação terminal média foi determinada como sendo 10 horas. Os enantiômeros (R, R) e (S, S) representaram cerca de 40% e 60% do medicamento inalterado excretado na urina, respectivamente. A proporção relativa dos dois enantiômeros permaneceu constante na faixa de dose estudada e não houve evidência de acúmulo relativo de um enantiômero sobre o outro após a administração repetida. Após a administração oral (40 a 80 mcg), 6% a 10% da dose foram recuperadas como medicamento inalterado na urina de indivíduos saudáveis de pesquisa; até 8% da dose foi recuperada como glicuronídeo. Um total de 67% de uma dose oral de formoterol é excretado na urina (principalmente como metabólitos) e o restante nas fezes. A depuração renal de formoterol é de 150 mL/min.
Populações especiais:
A farmacocinética de formoterol, até o momento, não foi estudada em pacientes com insuficiência renal e hepática. Entretanto, como o formoterol é eliminado principalmente via metabolismo hepático, pode ser esperado um aumento da exposição em pacientes com cirrose hepática grave.
Hipersensibilidade conhecida ao dipropionato de beclometasona, fumarato de formoterol e/ou quaisquer dos excipientes.
Pacientes com hipersensibilidade ao álcool não devem usar FOSTAIR®.
Este medicamento é contraindicado para menores de 18 anos.
FOSTAIR® deve ser usado com precaução e somente sob condições estritas de indicação em pacientes com arritmias cardíacas, especialmente bloqueio atrioventricular de terceiro grau e taquiarritmias, estenose subvalvar aórtica idiopática, cardiomiopatia hipertrófica obstrutiva, cardiomiopatia severa, especialmente infarto agudo do miocárdio, cardiopatia coronária, isquemia cardíaca, insuficiência cardíaca congestiva grave, doenças vasculares oclusivas, especialmente arteriosclerose, hipertensão arterial grave, aneurisma, hipertireoidismo, especialmente tireotoxicose, diabetes mellitus refratária, feocromocitoma e hipocalemia não tratada.
Como os corticosteroides podem apresentar propriedades imunossupressoras, é importante verificar com o paciente se ele recebeu vacina recentemente.
Deve haver precaução ao tratar pacientes com prolongamento do intervalo de QTc, por exemplo, induzido pelo medicamento ou congênito (QTc > 0,44 segundos). Formoterol pode induzir o prolongamento do intervalo de QTc.
Hipocalemia potencialmente grave pode resultar da terapia com agonista β-2. Precaução especial é aconselhada na asma grave uma vez que este efeito pode ser potencializado pela hipóxia e tratamento concomitante com outros medicamentos que podem induzir a hipocalemia, como os derivados das xantinas, esteroides e diuréticos. Também se recomenda ter precaução em caso de asma instável, quando vários broncodilatadores de resgate podem ser usados. É recomendado monitorar os níveis de potássio sérico em tais situações.
A inalação de formoterol pode causar elevação dos níveis de glicemia. Esse parâmetro deve, por isso, ser atentamente monitorado em pacientes diabéticos.
Se a anestesia com anestésicos halogenados for planejada, FOSTAIR® não deve ser administrado por no mínimo 12 horas antes do início da anestesia por existir um risco de arritmias cardíacas.
Risco de morte relacionado à Asma: Pacientes com asma devem ser informados que formoterol, um dos princípios ativos presentes em FOSTAIR®, pode aumentar o risco de morte relacionado à asma.
Assim como com toda medicação inalada contendo corticosteroides, FOSTAIR® deve ser administrado com cuidado em pacientes com tuberculose pulmonar ativa ou quiescente, infecções fúngicas e virais das vias aéreas.
É recomendado que a descontinuação do tratamento com FOSTAIR® não seja feita abruptamente. Recomenda-se que a dose seja reduzida gradualmente quando o tratamento é descontinuado.
O manejo da asma deve normalmente seguir um programa gradativo e a resposta do paciente deve ser monitorada clinicamente e por testes de função pulmonar.
Caso o paciente considere o tratamento ineficaz, deve-se buscar atenção médica. O uso crescente de broncodilatadores de resgate indica piora da condição clínica e requer uma reavaliação da terapia para asma. A deterioração súbita e progressiva do controle da asma representa uma ameaça à vida potencial e o paciente deve ser submetido a uma avaliação clínica urgente para modificação da terapia. Deve ser dada atenção em casos de necessidade de aumentar o tratamento com corticosteroides, tanto na terapia inalatória quanto por via oral, ou de tratamento com antibióticos se houver suspeita de uma infecção.
Para o tratamento de ataques asmáticos agudos, os pacientes devem ser aconselhados a manter o broncodilatador de ação rápida sempre disponível. Os pacientes devem ser lembrados de administrar FOSTAIR® diariamente como prescrito, mesmo quando estiverem assintomáticos.
A terapia não deve ser iniciada durante uma exacerbação ou em pacientes que apresentam uma significante piora ou deterioração aguda da asma. Eventos adversos sérios relacionados à asma e exacerbações podem ocorrer durante o tratamento com FOSTAIR®. Os pacientes devem ser orientados a continuar o tratamento, mas consultar um médico se os sintomas da asma permanecerem descontrolados ou se agravarem após o início do tratamento com FOSTAIR®.
Assim como com outras terapias inalatórias, broncoespasmo paradoxal pode ocorrer com aumento imediato da sibilância e rapidez da respiração após a administração. Esse fato deve ser tratado imediatamente com um broncodilatador inalatório de ação rápida. FOSTAIR® deve ser descontinuado imediatamente, o paciente deve ser avaliado e uma terapia alternativa instituída, se necessário.
FOSTAIR® não é destinado para tratamento inicial da asma.
Uma vez que os sintomas da asma são controlados, poderá considerar-se a redução gradual da dose de FOSTAIR®. É importante a avaliação regular dos pacientes no processo de redução gradual da dose. A menor dose eficaz de FOSTAIR® deve ser usada (uma apresentação com concentração menor, FOSTAIR® 100/6 mcg, está disponível).
Podem ocorrer efeitos sistêmicos com qualquer corticosteroide inalatório, especialmente em alta dose prescrita por períodos longos. Esses efeitos têm probabilidade menor de ocorrência com corticosteroides inalatórios em comparação aos orais. Possíveis efeitos sistêmicos incluem: Síndrome de Cushing, características da síndrome de Cushing, supressão adrenal, retardo do crescimento em crianças e adolescentes, redução da densidade mineral óssea, catarata e glaucoma e mais raramente uma variedade de efeitos psicológicos e comportamentais incluindo hiperatividade psicomotora, distúrbios do sono, ansiedade, depressão ou agressividade (particularmente em crianças). Portanto, é importante que o paciente seja avaliado regularmente e que a dose de corticosteroide inalatório seja reduzida à dose mais baixa na qual o controle eficaz da asma seja mantido.
O tratamento prolongado de pacientes com doses altas de corticosteroides inalatórios pode resultar em supressão adrenal e crise adrenal aguda. Situações que podem desencadear a crise adrenal aguda incluem trauma, cirurgia, infecção severa ou qualquer redução rápida da dose. Os sintomas apresentados são tipicamente vagos e podem incluir anorexia, dor abdominal, perda de peso, cansaço, cefaleia, náusea, vômito, hipotensão, nível reduzido de consciência, hipoglicemia e ataques convulsivos. A cobertura adicional de corticosteroide sistêmico deve ser considerada durante períodos de estresse ou cirurgia eletiva.
Deve haver precaução na transferência de pacientes para a terapia com FOSTAIR®, especialmente se houver qualquer motivo para supor que a função adrenal está comprometida por conta da terapia sistêmica prévia com esteroides.
Pacientes em transição da terapia oral para corticosteroides inalatórios podem permanecer sob risco de insuficiência adrenal por um período de tempo considerável. Pacientes que exigiram terapia de emergência de altas doses de corticosteroides no passado ou receberam tratamento prolongado com altas doses de corticosteroides inalatórios também podem estar sob risco. Essa possibilidade de insuficiência residual deve sempre ser considerada em situações de emergência e eletivas, passíveis de produzir estresse, e um tratamento com corticosteroide adequado deve ser considerado. A extensão do comprometimento adrenal pode exigir conselho de especialistas antes da realização de procedimentos eletivos.
Os pacientes devem ser orientados a enxaguar a boca com água ou escovar os dentes após inalar a dose prescrita para minimizar o risco de infecção orofaríngea por fungos e disfonia.
FOSTAIR® solução aerossol contém uma pequena quantidade de álcool (etanol). Existe a possibilidade teórica de uma interação com dissulfiram ou metronidazol, em pessoas que são particularmente sensíveis ao tratamento com esses medicamentos. No entanto, em doses normais, a quantidade de etanol é insignificante e não representa um risco para os pacientes.
Distúrbio visual: distúrbios visuais podem ser relatados com o uso sistêmico e tópico de corticosteroides. Se algum paciente apresentar sintomas como visão turva ou outras alterações visuais, o paciente deve ser encaminhado a um oftalmologista para avaliação de possíveis causas que podem incluir catarata, glaucoma ou doenças raras, como a coriorretinopatia serosa central, que têm sido notificadas após o uso de corticosteroides sistêmicos e tópicos.
Efeitos sobre a capacidade de conduzir e utilizar máquinas:
É improvável que FOSTAIR® cause efeito sobre a capacidade de conduzir e operar máquinas.
Uso na gravidez:
Categoria C – Não foram realizados estudos em animais e nem em mulheres grávidas; ou então, os estudos em animais revelaram risco, mas não existem estudos disponíveis realizados em mulheres grávidas.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Fertilidade
Não há informações em humanos. A presença de dipropionato de beclometasona em doses altas na combinação foi associada com redução de fertilidade da fêmea e embriotoxicidade em estudos com animais (ratos).
Gravidez
Não há estudo ou evidência de segurança para o uso do propelente HFA-134a em gestantes ou lactentes. Entretanto, estudos sobre o efeito do HFA-134a na função reprodutiva ou desenvolvimento embrio-fetal em animais não revelou efeitos adversos relevantes clinicamente.
Não há dados clínicos relevantes sobre o uso de FOSTAIR® em gestantes. Estudos em animais utilizando a combinação de dipropionato de beclometasona e formoterol mostrou evidências de toxicidade para a reprodução e para os fetos após alta exposição sistêmica (ver item “Dados de segurança pré-clínica”). Altas doses de corticosteroides administrados em animais prenhes são conhecidas por causar anormalidades no desenvolvimento fetal incluindo fenda palatina e retardo do crescimento intrauterino. Por causa das ações tocolíticas dos agentes beta2-simpatomiméticos, cuidado especial deve ser exercido no período antecedente ao parto. Formoterol não deve ser recomendado para uso durante a gravidez, e, particularmente no final da gravidez ou durante o parto, a menos que não haja alternativa estabelecida mais segura.
FOSTAIR® só deve ser usado durante a gravidez se os benefícios esperados superarem os riscos potenciais.
Uso na Lactação
Não há dados clínicos relevantes relacionados ao uso de FOSTAIR® durante a lactação em humanos.
Apesar de não haver informações disponíveis em experimentos com animais, é razoável assumir que o dipropionato de beclometasona seja secretado no leite, assim como outros corticosteroides.
Embora a passagem de formoterol para o leite materno seja desconhecida, ele foi detectado no leite de animais em lactação. A administração de FOSTAIR® em mulheres que estão amamentando deve ser considerada se os benefícios esperados forem maiores do que os riscos potenciais do tratamento. A decisão deve ser feita entre interromper a amamentação ou descontinuar a terapia com FOSTAIR® levando em consideração o benefício da amamentação para a criança e o benefício do tratamento para a mãe.
Uso criterioso no aleitamento ou na doação de leite humano. O uso deste medicamento no período da lactação depende da avaliação e acompanhamento do médico ou cirurgião-dentista.
USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO
Uso em crianças:
FOSTAIR® não é recomendado para crianças.
Uso em idosos:
Não é necessário ajuste de dose para pacientes idosos.
Gravidez e lactação:
Não há dados clínicos sobre mulheres usando o FOSTAIR® durante a gravidez ou amamentação.
Nota: FOSTAIR® não é apropriado para o tratamento de ataques asmáticos agudos.
Esse medicamento pode causar resultado positivo em testes antidopagem em atletas. Consulte a Lista Proibida vigente, Código Mundial Antidopagem disponível no endereço eletrônico da Autoridade Brasileira de Controle de Dopagem para mais informações.Este medicamento contém álcool (etanol) e pode causar intoxicação, especialmente em crianças.
Este medicamento pode potencializar o prolongamento do intervalo QT, o que aumenta o risco de ataque de arritmias ventriculares graves do tipo "torsades de pointes", que é potencialmente fatal (morte súbita).
Interações farmacocinéticas
O dipropionato de beclometasona é submetido a um metabolismo muito rápido via enzimas esterases.
A beclometasona é menos dependente do metabolismo do CYP3A do que alguns outros corticosteroides e, em geral, as interações são improváveis; entretanto, a possibilidade de efeitos sistêmicos com o uso concomitante de inibidores fortes do CYP3A (por exemplo, ritonavir, cobicistate) não pode ser excluída e, portanto, recomenda-se cautela e monitoramento apropriado com o uso de tais agentes.
Interações farmacodinâmicas
Βetabloqueadores (incluindo colírios) devem ser evitados por pacientes asmáticos. Caso sejam administrados por motivos maiores, o efeito do formoterol será reduzido ou extinto.
Por outro lado, o uso concomitante de outros medicamentos β-adrenérgicos pode ter efeitos potencialmente aditivos, portanto é necessário ter cuidado quando teofilina ou outro β-adrenérgico for prescrito concomitantemente com formoterol.
O tratamento concomitante com quinidina, disopiramida, procainamida, fenotiazinas, alguns anti-histamínicos (como a terfenadina), inibidores da monoaminoxidase e antidepressivos tricíclicos pode prolongar o intervalo de QTc e elevar o risco de arritmias ventriculares.
Além disso, L-Dopa, L-tiroxina, oxitocina e álcool podem comprometer a tolerância cardíaca à β2 simpatomiméticos.
O tratamento concomitante com inibidores da monoaminoxidase, incluindo agentes com propriedades semelhantes, como furazolidona e procarbazina, podem precipitar reações hipertensivas.
Há um risco elevado de arritmia em pacientes recebendo anestesia concomitante com hidrocarbonos halogenados.
Tratamento concomitante com derivados da xantina, esteroides ou diuréticos podem potencializar um possível efeito de hipocalemia do β-2-agonista. A hipocalemia pode elevar a disposição à arritmia em pacientes tratados com glicosídeos digitálicos.
Há um potencial teórico de interação particularmente em pacientes sensíveis utilizando dissulfiram ou metronidazol, pois FOSTAIR® solução aerossol contém álcool e sua interação com dissulfiram pode causar vermelhidão e com metronidazol pode ocorrer vermelhidão, vômitos e taquicardia.
Os pacientes devem ser avisados que o FOSTAIR® contém pequena porcentagem de álcool, [cerca de 9 mg por acionamento (dose)]. Em doses normais, não há risco para os pacientes.
A validade do FOSTAIR® é de 17 meses.
Antes do paciente iniciar o uso: Armazenar em geladeira (entre 2°C e 8°C).
Após o paciente iniciar o uso: Armazenar em temperatura ambiente (15oC a 30oC). Após armazenagem em temperatura ambiente, válido por 2 meses.
Proteger do calor.
Atenção: no cartucho do medicamento, há um local para incluir a data do 1º uso e a data de validade em temperatura ambiente. A data de validade em temperatura ambiente não pode ser posterior à data de validade do lote (vide informação impressa na embalagem).
FOSTAIR® é uma lata pressurizada cujo jato, uma névoa incolor, tem leve odor e sabor alcoólico.
Importante: A lata de FOSTAIR® é pressurizada. Não tentar furá-la, quebrá-la ou queimá-la, mesmo quando vazia. O recipiente não deve ser exposto a fontes de calor.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Para garantir a administração adequada do medicamento, o paciente deve ser orientado pelo médico ou outro profissional de saúde sobre como usar o dispositivo. O uso correto é essencial para que o tratamento seja bem-sucedido. O paciente deve ser aconselhado a ler a bula com cuidado e a seguir as instruções de uso.
Modo de usar:
FOSTAIR® deve ser utilizado somente por via inalatória (oral).
FOSTAIR® é fornecido em frasco de alumínio pressurizado acoplado a um dispositivo de plástico que contém uma tampa de proteção no bocal. Na parte de trás do dispositivo há um contador de acionamento (dose) que indica quantos acionamentos (doses) do medicamento ainda estão disponíveis. Cada vez que o paciente acionar o inalador (apertar o frasco de alumínio), ele liberará um acionamento (dose) e o contador diminuirá em uma unidade. O paciente deve tomar cuidado para não deixar o inalador cair, pois isso pode fazer com que o dispositivo seja acionado e uma dose seja perdida.
Testando o inalador:
Antes da primeira utilização do dispositivo e após um período de 14 dias ou mais sem utilizar, o paciente deve acionar o inalador no ar uma vez para garantir o funcionamento sem falhas do dispositivo. Após testar o inalador pela primeira vez, o contador deve mostrar 120.
Uso do Inalador:
Se o medicamento tiver sido exposto ao frio e estiver gelado, o paciente deve ser orientado a retirar o frasco de alumínio do dispositivo em L e aquecê-lo entre as mãos por alguns minutos antes de utilizar. O medicamento nunca deve ser aquecido por meios artificiais.
Os pacientes devem ficar o mais próximo possível de uma posição ereta, seja sentado ou em pé, durante a inalação.
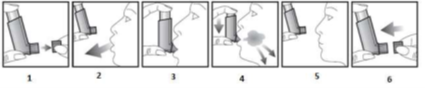
Para garantir a continuidade do tratamento, o paciente deve ser orientado a adquirir outra unidade quando o contador estiver aproximando-se do zero.
Importante: O paciente não deve fazer as etapas de 2 a 5 de maneira muito rápida.
Caso outra dose seja necessária, o paciente deve manter o dispositivo na posição vertical por cerca de trinta segundos e em seguida repetir as etapas 2 a 5.
Após o uso, o paciente deve fechar o dispositivo em L com a tampa protetora.
Caso o paciente perceba que parte do medicamento tenha sido liberada pela parte superior do dispositivo ou pelo canto da boca, o procedimento de administração deve ser repetido a partir da etapa 2.
Para pacientes com dificuldade de segurar o dispositivo, pode ser mais fácil fazê-lo com as duas mãos. Portanto, a parte superior do dispositivo será segurada com os dois dedos indicadores e sua parte inferior com os polegares.
Os pacientes devem enxaguar a boca ou gargarejar com água ou escovar os dentes após a inalação (vide item 5 “ADVERTÊNCIAS E PRECAUÇÕES”).
Se o paciente apresentar dificuldade para sincronizar o acionamento do dispositivo com a inspiração, ele poderá fazer uso de espaçador do tipo AeroChamber Plus®. Neste caso, o paciente deve ser orientado sobre o correto uso do dispositivo com espaçador, e a técnica utilizada pelo paciente deve ser conferida pelo médico ou farmacêutico para garantir a correta deposição do medicamento no pulmão.
Limpeza:
Para a limpeza regular do dispositivo, os pacientes devem ser orientados a retirar a tampa de proteção e limpar a parte interna e externa do bocal com um pano limpo e seco. Os pacientes não devem remover o frasco de alumínio do dispositivo em L e nem utilizar água ou outros líquidos para a limpeza do bocal.
Posologia:
FOSTAIR® não é indicado para o tratamento inicial da asma. A administração dos componentes é individual e deve ser ajustada à severidade da doença. Isso deve ser considerado não apenas quando o tratamento com associação fixa é iniciado, mas também quando a dose é ajustada. Caso um paciente necessite de uma combinação de doses diferentes da combinação disponível no inalador, doses adequadas de agonista β-2 e/ou corticosteroides através de inaladores individuais devem ser prescritas.
Em relação à duração do tratamento, o profissional da saúde deve avaliar cada caso.
Dipropionato de beclometasona em FOSTAIR® é caracterizado por uma distribuição de partículas extrafinas a qual resulta em um efeito mais potente do que o efeito de formulações de dipropionato de beclometasona com distribuição de partículas não extrafinas (100 mcg de dipropionato de beclometasona extrafina de FOSTAIR® podem ser comparados a 250 mcg de dipropionato de beclometasona de formulações não extrafinas). Devido à distribuição de partículas extrafinas da formulação de FOSTAIR®, é necessário ajuste de dose quando o paciente for transferido de um medicamento com formulação não extrafina para FOSTAIR®. Deve ser considerado que a dose diária total de dipropionato de beclometasona para FOSTAIR® será menor que a dose de dipropionato de beclometasona do medicamento que não possui formulação extrafina.
Doses Recomendadas:
Dose recomendada para adultos com mais de 18 anos:
Recomenda-se utilizar 2 acionamentos (doses), a cada 12 horas (duas vezes ao dia).
A dose máxima diária é de 4 acionamentos (doses).
FOSTAIR® 200/6 deve ser usado apenas como terapia de manutenção. A dosagem mais baixa (FOSTAIR® 100/6) está disponível para terapia de manutenção e alívio.
Os pacientes devem ser aconselhados a ter um broncodilatador de curta ação disponível para uso em caso de crise.
Os pacientes devem ser regularmente reavaliados pelo médico, para assegurar que a dosagem de FOSTAIR® mantém-se adequada. A dose deve ser ajustada à dose mínima que permita manter um controle eficaz dos sintomas. Quando o controle dos sintomas é mantido em longo prazo com a dose mais baixa, o próximo passo poderá incluir um tratamento de monoterapia com corticosteroide inalatório.
FOSTAIR® 200/6 não deve ser utilizado como tratamento de step-down. Para esse tipo de estratégia de tratamento, está disponível o medicamento com menor concentração de dipropionato de beclometasona (FOSTAIR® 100/6).
Os pacientes devem ser instruídos a usar FOSTAIR® diariamente, mesmo quando estiverem assintomáticos.
Grupos especiais de pacientes:
Não é necessário ajuste de dose para pacientes idosos.
Não há dados disponíveis sobre a utilização de FOSTAIR® em pacientes com insuficiência hepática ou renal.
Não é recomendado o uso em crianças.
Uma vez que FOSTAIR® contém dipropionato de beclometasona e fumarato de formoterol, o tipo e severidade das reações adversas associadas a cada composto podem ser previstos.
As reações adversas reportadas durante os estudos clínicos e experiência clínica com FOSTAIR® solução aerossol são listadas a seguir:
Reação muito comum (> 1/10): não foram relatadas reações muito comuns até o momento.
Reação comum (> 1/100 e < 1/10): faringite, candidíase oral, cefaleia, disfonia.
Reação incomum (> 1/1.000 e < 1/10): gripe, infecção fúngica oral, candidíase orofaríngea e esofágica, candidíase vulvovaginal, gastroenterite, sinusite, rinite, pneumonia*, granulocitopenia, dermatite alérgica, hipocalemia, hiperglicemia, inquietação, tremor, tontura, otite, palpitações, eletrocardiograma com prolongamento do intervalo QT corrigido, taquicardia, taquiarritmia, alteração em eletrocardiograma, fibrilação atrial*, hiperemia, rubor, tosse, tosse produtiva, irritação na garganta, crise asmática, eritema faríngeo, diarreia, boca seca, dispepsia, disfagia, sensação de queimação nos lábios, náusea, disgeusia, prurido, rash, hiperidrose, urticaria, espasmos musculares, mialgia, proteína C-reativa elevada, contagem de plaquetas elevada, aumento de ácidos graxos livres, aumento na insulina sanguínea, aumento de corpos cetônicos sanguíneos, diminuição do cortisol sanguíneo*, aumento da pressão sanguínea.
Reação rara (> 1/10.000 e < 1/1.000): extrassístole ventricular, angina pectoris, broncoespasmo paradoxal, angioedema, nefrite, diminuição da pressão sanguínea.
Reação muito rara (< 1/10.000): trombocitopenia, reações de hipersensibilidade, incluindo eritema, edema nos lábios, face, olhos e faringe, supressão adrenal, catarata, glaucoma, dispneia, exacerbação da asma, retardo no crescimento em crianças e adolescentes, edema periférico, diminuição da densidade óssea.
Reação cuja frequência é desconhecida (não pode ser calculada a partir dos dados disponíveis): hiperatividade psicomotora (atividade psíquica e motora aumentada), distúrbios do sono, ansiedade, depressão, agressividade, mudanças comportamentais (predominantemente em crianças), visão turva.
*Um caso não sério de pneumonia foi relatado por um paciente em tratamento com FOSTAIR® 100/6 em um estudo clínico pivotal de tratamento de DPOC. Outras reações adversas observadas no estudo de FOSTAIR® 100/6 para DPOC foram: redução dos níveis de cortisol sanguíneo e fibrilação atrial.
Reações adversas típicas associadas ao uso de formoterol:
Dentre as reações adversas observadas, aquelas tipicamente associadas ao formoterol são, por exemplo: hipocalemia, cefaleia, tremor, palpitações, tosse, espasmos musculares, prolongamento do intervalo QTc.
Reações adversas típicas associadas ao uso de beclometasona:
Dentre as reações adversas observadas, aquelas as reações adversas tipicamente associadas à administração de dipropionato de beclometasona são, por exemplo: infecção oral fúngica, candidíase oral, disfonia, irritação da garganta.
Disfonia e candidíase podem ser aliviadas realizando gargarejo e enxague da boca com água ou escovação dos dentes depois de usar o produto. Candidíase sintomática pode ser tratada com antifúngicos tópicos durante o tratamento com FOSTAIR®.
Assim como ocorre com outros corticosteroides inalatórios, podem ocorrer efeitos sistêmicos, especialmente em alta dose prescrita por períodos longos. Possíveis efeitos sistêmicos incluem: Síndrome de Cushing, características da síndrome de Cushing, supressão adrenal, redução da densidade mineral óssea, retardo do crescimento em crianças e adolescentes, catarata e glaucoma.
Reações de hipersensibilidade incluindo erupções cutâneas, urticária, prurido, eritema e edema de olhos, face, lábios e garganta têm sido reportadas.
Assim como ocorre com outras terapias inalatórias, pode ocorrer broncoespasmos paradoxais com imediato aumento na rouquidão, tosse e falta de ar após a administração do medicamento.
Reações adversas reportadas para medicamento semelhante (outra forma farmacêutica) contendo a associação de dipropionato de beclometasona e formoterol:
Reação muito comum (> 1/10): não foram relatadas reações muito comuns até o momento.
Reação comum (> 1/100 e < 1/10): tremor.
Reação incomum (> 1/1.000 e < 1/10): nasofaringite, candidíase oral, hipertrigliceridemia, cefaleia, taquicardia, bradicardia sinusal, angina pectoris, isquemia do miocárdio, irritação na garganta, exacerbação da asma, dispneia, dor orofaríngea, disfonia, tosse, náusea, fadiga, irritabilidade, eletrocardiograma com prolongamento do intervalo QT, diminuição de cortisol livre na urina, diminuição do cortisol sanguíneo, aumento do potássio sanguíneo, aumento da glicose sanguínea, progressão lenta da onda R no eletrocardiograma.
Reação rara (> 1/10.000 e < 1/1.000): não foram relatadas reações raras até o momento.
Reação muito rara (< 1/10.000): não relatadas reações muito raras até o momento.
Reação cuja frequência é desconhecida (não pode ser calculada a partir dos dados disponíveis): hiperatividade psicomotora, distúrbios do sono, ansiedade, depressão, agressividade, mudanças comportamentais (predominantemente em crianças), visão turva.
Atenção: este produto é um medicamento que possui nova concentração no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
A dose máxima recomendada de FOSTAIR® 200/6 em uma administração única é de 2 acionamentos (doses). Quatro acionamentos (doses) cumulativos de FOSTAIR® DPI 200/6 (total de 800 mcg de dipropionato de beclometasona e 24 mcg de formoterol administrados como uma única dose) foram estudadas em pacientes asmáticos. O tratamento cumulativo não causou efeitos anormais clinicamente relevantes nos sinais vitais, e eventos adversos sérios ou graves não foram observados.
Doses inaladas de FOSTAIR® 100/6 até doze acionamentos cumulativos (total de dipropionato de beclometasona de 1.200 microgramas, formoterol 72 microgramas) foram estudadas em pacientes asmáticos. Os tratamentos cumulativos não causaram efeito anormal nos sinais vitais, e eventos adversos sérios ou graves não foram observados.
Doses excessivas de formoterol podem resultar em efeitos típicos de agonistas β-2-adrenérgicos: náusea, vômito, cefaleia, tremor, sonolência, palpitações, taquicardia, arritmias ventriculares, prolongamento do intervalo QTc, acidose metabólica, hipocalemia, hiperglicemia.
Em caso de superdose de formoterol, é indicado tratamento sintomático e de suporte. Casos graves devem ser internados. O uso de bloqueadores β-adrenérgicos cardiosseletivos pode ser considerado, mas com extrema precaução, uma vez que o uso de medicação bloqueadora β-adrenérgica pode provocar broncoespasmo. O potássio sérico deve ser monitorado.
A inalação aguda de doses em excesso de dipropionato de beclometasona pode resultar em supressão temporária da função adrenal. Não é necessária ação emergencial uma vez que a função adrenal se recupera em poucos dias, como verificado por medidas de cortisol plasmático. Nestes pacientes o tratamento deve ser mantido em dose suficiente para controlar a asma.
Sobre a superdose crônica de dipropionato de beclometasona inalada, ver o item 5 “ADVERTÊNCIAS E PRECAUÇÕES” (risco de supressão adrenal). Pode ser necessário monitoramento da reserva adrenal. O tratamento deve ser continuado na dose suficiente para controlar a asma.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS:
Registro: 1.0058.0114
Registrado e Importado por:
Chiesi Farmacêutica Ltda.
Rua Dr. Giacomo Chiesi nº 151 - Estrada dos Romeiros km 39,2
Santana de Parnaíba - S.P.
CNPJ n° 61.363.032/0001-46 - ® Marca Registrada
SAC (Serviço de Atendimento ao Consumidor): 0800 1104525
www.chiesi.com.br
Produzido por: Chiesi Farmaceutici S.p.A - Parma - Itália
Embalado (embalagem secundária) por:
Chiesi Farmaceutici S.p.A – Parma – Itália
OU
Chiesi Farmacêutica Ltda.- Santana de Parnaíba - S.P - Brasil
Venda sob prescrição
Esta bula foi aprovada pela Anvisa em 06/01/2025

FOSTAIR 200_AER _100580114_VPS2