dipropionato de beclometasona 100 mcg
fumarato de formoterol 6 mcg
Solução Aerossol

Bula Profissional de Saúde
IDENTIFICAÇÃO DO MEDICAMENTO
FOSTAIR® 100/6
dipropionato de beclometasona 100 mcg
fumarato de formoterol 6 mcg
APRESENTAÇÕES:
Solução aerossol. Frasco contendo 120 doses (jatos), acompanhado de inalador (dispositivo para aplicação oral em forma de L), com contador de dose. Cada dose (jato) contém 100 mcg de dipropionato de beclometasona e 6 mcg de fumarato de formoterol.
USO INALATÓRIO POR VIA ORAL
USO ADULTO
COMPOSIÇÃO:
Cada dose (jato) de FOSTAIR® (aerossol) contém:
|
dipropionato de beclometasona.................................................................... |
100 mcg |
|
fumarato de formoterol.................................................................................. |
6 mcg |
|
Excipiente qsp............................................................................................... |
1 dose |
Excipientes: ácido clorídrico, álcool etílico e norflurano (HFA-134a).
O produto não contém substâncias prejudiciais para a camada de ozônio.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE
Asma:
FOSTAIR® é indicado no tratamento regular da asma, no qual o uso de uma combinação fixa (broncodilatador de longa ação β-2-agonista e corticosteroide inalado) é considerado adequado para:
- Pacientes não controlados adequadamente através de inalação de corticosteroides e agonistas β-2 de ação rápida, quando necessário, ou
- Pacientes controlados adequadamente com inalação de corticosteroides e agonista β-2 de ação prolongada.
FOSTAIR® pode ser utilizado como um tratamento de manutenção regular e também em resposta aos sintomas da asma, quando necessário.
FOSTAIR® não é indicado para o tratamento inicial da asma.
DPOC:
FOSTAIR® está também indicado no tratamento regular de pacientes com doença pulmonar obstrutiva crônica (DPOC) grave, com sintomas frequentes e história de exacerbações, apesar de tratamento com broncodilatadores.
2.1 Dados de Segurança Pré-Clínica:
A toxicidade observada em estudos com animais com dipropionato de beclometasona e formoterol, administrados em combinação ou separadamente, foram decorrentes de efeitos associados à atividade farmacológica aumentada. Eles estão relacionados à atividade imunossupressora de dipropionato de beclometasona e aos efeitos cardiovasculares conhecidos do formoterol, evidentes principalmente em cães. Não foram observadas elevações da toxicidade ou ocorrência de achados inesperados.
Estudos da reprodução de ratos (0,2; 2,0 e 20 mg/kg/dia) apresentaram efeitos dependentes da dose. Não foram observados efeitos na fertilidade de machos, ao passo que o NOAEL (maior nível em que não se observou efeito adverso) em fêmeas e no desenvolvimento fetal foi de 2 mg/kg/dia. Em doses mais altas (20 mg/kg/dia), FOSTAIR® induziu dificuldades no parto e sinais de toxicidade materna (taxa de implantação reduzida, peso reduzido da placenta) e fetal (distúrbios da ossificação, peso reduzido). Sabe-se que a administração de corticosteroides em doses altas a animais prenhes pode causar anormalidades no desenvolvimento fetal incluindo fissura palatal e retardo do crescimento intrauterino. A ação tocolítica de agentes simpatomiméticos β-2 pode influenciar o parto.
Dados não clínicos dos componentes individuais de FOSTAIR® não mostraram perigo para humanos, baseado nos estudos convencionais de segurança farmacológica e de toxicidade de dose repetida. O perfil de toxicidade da combinação refletiu os de toxicidade dos componentes separados sem aumento na toxicidade ou de achados inesperados.
Estudos sobre a reprodução de ratos mostrou efeitos dependentes de dose. A presença de altas doses de dipropionato de beclometasona foi associada com a redução na fertilidade das fêmeas, diminuição no número de implantações e toxicidade embriofetal. Sabe-se que altas doses de corticosteroides em animais prenhes causam anormalidades no desenvolvimento fetal incluindo fenda palatal e crescimento intrauterino diminuído, e é provável que os efeitos observados com o uso da combinação dipropionato de beclometasona/formoterol sejam em função do dipropionato de beclometasona. Estes efeitos foram observados apenas com exposição sistêmica elevada ao metabólito ativo B-17-MP (beclometasona 17-monopropionato), mais de 200 vezes dos níveis séricos esperados em pacientes. Além disso, aumento na duração da gestação e do parto, atribuído ao efeito tocolítico do β-2-simpatomimético foi visto em estudos com animais. Estes efeitos foram observados quando o nível sérico materno de formoterol era menor que o nível esperado em pacientes tratados com FOSTAIR®.
Não foram realizados estudos de oncogenicidade com FOSTAIR®. Contudo, não foi evidenciado potencial de mutagenicidade com a combinação, e os dados relatados por indivíduos não sugerem qualquer risco potencial de oncogenicidade em homens.
Asma: terapia de manutenção:
A eficácia da combinação fixa de beclometasona e formoterol (BDP/F - FOSTAIR®) foi avaliada em um estudo randomizado, controlado, durante 3 meses, em pacientes com asma moderada que permaneciam sintomáticos apesar de receberem baixa dose de corticoide inalatório, até 500 mcg/dia de beclometasona (BDP) ou equivalente. FOSTAIR® foi aplicado, por inalação, duas vezes ao dia, provando ser mais eficaz na melhora da função pulmonar que uma dose dupla equipotente de BDP não extrafina. (Dhillon e Keating 2006; Bonnet-Gonod et al 2006a). Uma segunda investigação foi realizada em pacientes com asma mais severa, caracterizada por sintomas recorrentes e insuficiência respiratória, apesar do tratamento com até 1000 mcg/dia de BDP ou equivalente. Nesse contexto, BDP/formoterol, administrado 2 vezes ao dia durante seis meses, mostrou uma melhoria no pico do fluxo expiratório (PFE) e volume expiratório forçado (VEF1), comparável com a de um regime equipotente, não extrafino, de aplicação de beclometasona e formoterol administrado através de dispositivos separados, e provou ser mais eficaz do que 1000 mcg/dia de beclometasona não extrafina. Além disso, a combinação fixa de beclometasona/formoterol foi superior a monoterapia com beclometasona e formoterol inalados separadamente ou com a monoterapia utilizando-se beclometasona apenas, em termos percentuais de medidas necessárias para o controle clínico da asma, sugerindo que os pacientes que recebem a combinação extrafina de beclometasona e formoterol (FOSTAIR®) podem apresentar benefícios adicionais que são estendidos a melhora da função pulmonar. O percentual de pacientes com exacerbações de asma que requerem esteroides por via oral (percentagem referida como pacientes com exacerbações graves) foi menor no grupo tratado com a combinação fixa de beclometasona e formoterol (6,0%) do que aqueles que recebem beclometasona e formoterol separadamente (12,1%) ou beclometasona isoladamente (14,1%). A medida dos níveis de cortisol sérico na semana 24 foi significativamente maior no grupo que recebeu a combinação fixa de beclometasona e formoterol em relação aos valores basais, enquanto que nenhuma alteração foi observada nos outros dois grupos, sugerindo que a combinação do FOSTAIR® produziu uma menor inibição do eixo hipotálamo-pituitária-adrenal comparado com os outros tratamentos. Estes resultados estão de acordo com a baixa ingestão de esteroides, que caracteriza a formulação do FOSTAIR®. Finalmente, nenhuma anormalidade clinicamente significativa foi observada em relação ao potássio sérico e glicose. (Dhillon e Keating 2006; Bonnet-Gonod et al 2006b).1,2,3
Em dois estudos clínicos “head-to-head” (comparação direta), foram avaliadas a eficácia e tolerabilidade da beclometasona e formoterol (BDP/F -FOSTAIR®) vs budesonida/ formoterol (BUD/F) e propionato de fluticasona/salmeterol (FP/S). Os dois estudos partilharam um desenho de estudo semelhante. O critério de inclusão dos pacientes no estudo foram sintomas da asma e função pulmonar (VEF1) < 80% do previsto, apesar de receberem até 1000 mcg / dia BDP ou equivalente. No primeiro estudo, (Papi et al 2007a), os pacientes que receberam 2 inalações duas vezes ao dia de FOSTAIR® apresentaram melhora na função pulmonar, medida pela avaliação do (PEF), antes da administração do medicamento pela manhã, que era comparável com a de um regime equipotentes de 2 aplicações duas vezes ao dia de BUD/F 200/6 mcg. Notadamente, quando a velocidade de broncodilatação que foi avaliada como a mudança no VEF1 nos primeiros 60 min após a dose de manhã, no primeiro e no último dia do tratamento, FOSTAIR® (BDP / F) demonstrou um início de ação equivalente à de BUD/F. Ambos os tratamentos foram igualmente eficazes na melhora dos sintomas da asma e aumento da percentagem de dias sem o uso de medicação de resgate. No segundo ensaio (Papi et al 2007b), BDP/F foi comparada com propionato de fluticasona / salmeterol (FP/S) 125/25 mcg, os dois administrados em 2 doses 2 vezes ao dia. A associação de BDP/F mostrou melhora no PFE e VEF1 comparável aos efeitos da FP/S quando a função pulmonar foi medida na pré-dose. O início da broncodilatação, avaliada como uma mudança no VEF1 nos primeiros 60 minutos após a dose de manhã, no primeiro e no último dia de tratamento, foi significantemente mais rápida com o FOSTAIR® (BDP/F) do que com FP/S, devido principalmente às propriedades farmacodinâmicas do formoterol. 4,5
Asma: terapia de manutenção e alívio:
Em um estudo paralelo de 48 semanas envolvendo 1701 pacientes com asma, a eficácia de FOSTAIR®, solução inalatória, administrado como terapia de manutenção (1 dose, duas vezes ao dia) e alívio (até um total de 8 inalações ao dia) foi comparada ao FOSTAIR® administrado como terapia de manutenção (1 dose, duas vezes ao dia) mais salbutamol quando necessário em pacientes adultos com asma moderada ou severa não controlada e >80% dos pacientes utilizando beta2-agonistas de longa ação ao início do estudo. O objetivo primário do estudo foi demonstrar a superioridade de FOSTAIR® utilizado como manutenção e alívio em termos de tempo para a primeira exacerbação severa da asma. O resultado confirmou que FOSTAIR® utilizado como terapia de manutenção e alívio prolongou significativamente o tempo para a primeira exacerbação severa quando comparado com FOSTAIR® administrado como manutenção mais salbutamol quando necessário (p< 0,001 para ambas população ITT e PP) e reduziu o risco de ocorrer uma exacerbação severa da asma em 36% (IC: 18% - 51%) versus salbutamol quando necessário. Exacerbações que requerem corticosteroides orais e hospitalizações ou visitas ao serviço de emergência foram significativamente menores no grupo utilizando FOSTAIR® como terapia de manutenção e alívio. Pacientes utilizando FOSTAIR® como terapia de manutenção e alívio alcançaram uma melhora significativa no controle da asma.
CT07 Resultados Secundários:
|
Resultados Secundários
|
FOSTAIR® + FOSTAIR® quando necessário (825 pacientes) |
FOSTAIR® + salbutamol quando necessário (849 pacientes) |
% Redução de eventos/ pacientes-ano |
||
|
Eventos |
Eventos/ paciente - ano |
Eventos |
Eventos/ paciente - ano |
||
|
Exacerbações severas da asma |
130 |
0,176 |
196 |
0,267 |
34% |
|
Uso de corticosteroides sistêmicos para tratamento da asma |
125 |
0,169 |
190 |
0,259 |
34% |
|
Hospitalização ou visita ao serviço de emergência devido à asma |
67 |
0,09 |
99 |
0,135 |
33% |
P<0,001 FOSTAIR® + FOSTAIR® quando necessário versus FOSTAIR® + salbutamol quando necessário. 6
Em outro estudo clínico, uma dose simples de FOSTAIR®100/6 mcg, solução inalatória, provocou um efeito broncodilatador acelerado e um alívio rápido dos sintomas de dispneia similar ao do salbutamol 200 mcg/dose em pacientes asmáticos submetidos ao desafio com metacolina é utilizado para induzir a broncoconstrição.7
DPOC
Avaliar o efeito da beclometasona + formoterol versus budesonida + formoterol (não inferioridade) e em comparação com o formoterol (superioridade), em pacientes com doença pulmonar obstrutiva crônica grave estável (DPOC): Um estudo duplo-cego, double-dummy, randomizado, controlado com ativo, de grupos paralelos foi realizado em pacientes com DPOC de severa intensidade, durante 48 semanas. Após 4 semanas de run-in com o ipratrópio + salbutamol (40/200 mcg, três vezes ao dia), os pacientes foram randomizados para receber beclometasona + formoterol (200/12 mcg em inalador pressurizado dosimetrado), budesonida + formoterol (400/12 mg com inalador de pó seco) ou formoterol (12 mg inalador de pó seco), administrados duas vezes ao dia, durante 48 semanas. As co-variáveis de eficácia primária foram mudança dos valores basais do VEF1 após 48 semanas de tratamento e a taxa média das exacerbações da DPOC. Resultados: Dos 718 pacientes randomizados, 703 (232 beclometasona + formoterol, 238 com budesonida + formoterol e 233 com formoterol) foram avaliados na análise ITT. Melhora na pré-dose do VEF1 matinal foi de 0,077 L, 0,080 L e 0,026 L com beclometasona / formoterol, budesonida / formoterol e formoterol, respectivamente (LS médio do modelo ANCOVA). Beclometasona / formoterol não foi inferior ao de budesonida / formoterol (95% IC da diferença 0,052, 0,048) e superior com o formoterol (p = 0,046). A taxa geral de exacerbações de DPOC / paciente / ano foi semelhante e não significativamente estatisticamente diferente entre os tratamentos (beclometasona / formoterol 0,414, budesonida / formoterol 0,423 e formoterol 0,431). Qualidade de vida e sintomas da DPOC melhoraram em todos os grupos e uso de medicação de emergência diminuiu. Perfis de segurança foram como esperado e os tratamentos, bem tolerado. Conclusões: Beclometasona / formoterol (400/24 mcg) durante 48 semanas, melhorou a função pulmonar, reduziu os sintomas em comparação com o formoterol, foi seguro e bem tolerado em pacientes com DPOC estável grave. 8
Referências Bibliográficas:
Mecanismos de Ação e Efeitos Farmacodinâmicos:
FOSTAIR® contém dipropionato de beclometasona e formoterol, na forma de aerossol (solução pressurizada contendo o gás HFA), liberando partículas extrafinas com uma média de diâmetro aerodinâmico de massa de 1,4-1,5 micrômetros e uma deposição pulmonar alta e homogênea. As partículas extrafinas de FOSTAIR® são em média muito menores que as partículas de formulações não extrafinas.
Um estudo de deposição do fármaco marcado com radioisótopos, em adultos asmáticos, mostrou que a maioria do fármaco (55% da dose emitida) se depositou nos pulmões e uma quantidade limitada (43% da dose emitida) teve deposição extratorácica. Estas características de liberação permitem uma baixa dose de corticosteroide com melhores efeitos farmacodinâmicos, os quais mostraram ser equivalentes a uma dose correspondente de solução pressurizada para inalação.
Os mecanismos de ação das duas substâncias são discutidos a seguir.
O dipropionato de beclometasona, administrado por inalação e em doses recomendadas, apresenta ação anti-inflamatória, resultando em redução dos sintomas e exacerbações da asma, com menos efeitos adversos do que quando corticosteroides são administrados por via sistêmica.
Formoterol é um agonista β-2-adrenérgico seletivo que produz relaxamento do músculo liso brônquico em pacientes com obstrução reversível das vias aéreas. O efeito broncodilatador surge rapidamente, em 1-3 minutos após a inalação, e dura 12 horas após uma única administração.
Propriedades Farmacocinéticas:
A exposição sistêmica aos princípios ativos dipropionato de beclometasona e formoterol na combinação fixa do FOSTAIR® foi comparada à exposição sistêmica dos componentes isolados, em estudo clínico.
Para o dipropionato de beclometasona, a AUC do seu principal metabólito ativo beclometasona 17-monopropionato (B-17-MP) e sua concentração plasmática máxima foram inferiores após a administração da combinação fixa, porém, a taxa de absorção foi mais rápida em comparação à administração de beclometasona isolada.
Para o formoterol, a concentração plasmática máxima foi semelhante após a administração da combinação fixa ou dos componentes isolados e a exposição sistêmica foi ligeiramente superior após administração de FOSTAIR®.
Não houve evidência de interações farmacocinética ou farmacodinâmica entre dipropionato de beclometasona e formoterol.
Em um estudo realizado em voluntários sadios, o uso de FOSTAIR® aerossol com o espaçador Aerochamber Plus® aumentou a deposição de dipropionato de beclometasona e formoterol no pulmão sem aumentar a exposição sistêmica total em comparação ao uso do dispositivo de aplicação padrão (bocal em L).
Dipropionato de beclometasona
O dipropionato de beclometasona é uma pró-droga com fraca afinidade de ligação com o receptor de glicocorticoide que é hidrolisado via enzimas esterases para um metabólito ativo que é a beclometasona-17-monopropionato (B-17-MP), o qual tem uma atividade anti-inflamatória tópica mais potente se comparado à pró-droga (dipropionato de beclometasona).
Absorção e distribuição:
O dipropionato de beclometasona inalado é rapidamente absorvido pelos pulmões; antes da absorção há uma vasta conversão de dipropionato de beclometasona em seu metabólito ativo B-17-MP.
A biodisponibilidade do dipropionato de beclometasona deglutido é insignificante, mas a conversão pré-sistêmica para B-17-MP resulta em 41% de absorção como B-17-MP. Há um aumento aproximadamente linear na exposição sistêmica com o aumento da dose inalada. A biodisponibilidade absoluta após a inalação é de aproximadamente 2% e 62% da dose nominal para o dipropionato de beclometasona inalterado e B-17-MP, respectivamente. Após a administração intravenosa, a disposição de dipropionato de beclometasona e B-17-MP se caracteriza por alta depuração plasmática (150 e 120L/h respectivamente), com pequeno volume de distribuição em estado de equilíbrio para dipropionato de beclometasona (20L) e ampla distribuição tecidual para B-17-MP (424L). A disposição metabólica do dipropionato de beclometasona resulta principalmente em seu metabólito ativo (B-17-MP). A ligação proteica plasmática é moderadamente elevada (87%).
Metabolismo:
O dipropionato de beclometasona é depurado muito rapidamente da circulação sistêmica, pelo metabolismo mediado via enzimas esterases que são encontradas na maioria dos tecidos. O principal produto do metabolismo é o metabólito ativo (B-17-MP). Metabólitos secundários inativos, 21-monopropionato de beclometasona (B-21-MP) e beclometasona (BOH) também são formados, mas eles contribuem pouco com a exposição sistêmica.
Excreção:
A excreção fecal é a principal via de eliminação de dipropionato de beclometasona, principalmente como metabólitos polares. A excreção renal de dipropionato de beclometasona e seus metabólitos são desprezíveis. As meias-vidas de eliminação terminal são 0,5h e 2,7 h para dipropionato de beclometasona e B-17-MP, respectivamente.
Populações especiais:
Uma vez que o dipropionato de beclometasona é submetido a um metabolismo muito rápido via enzimas esterases (presentes no líquido intestinal, soro, pulmões e fígado,) para originar produtos mais polares (B-21-MP, B-17-MP e BOH), é pouco provável que o comprometimento hepático modifique o perfil de segurança e a farmacocinética do dipropionato de beclometasona. A farmacocinética do dipropionato de beclometasona em pacientes com comprometimento renal não foi estudada. Não é esperado que a insuficiência hepática modifique a farmacocinética e o perfil de segurança do dipropionato de beclometasona. Uma vez que o dipropionato de beclometasona ou seus metabólitos não foram observados na urina, uma elevação na exposição sistêmica não foi verificada em pacientes com comprometimento renal.
Formoterol
Absorção e distribuição:
Após a inalação, o formoterol é absorvido a partir dos pulmões e do trato gastrointestinal. A fração de dose inalada que é engolida depende do tipo de dispositivo usado e da técnica de inalação: com um MDI (aerossol) pode chegar a 90%, portanto, os dados relacionados à administração oral são relevantes para a via inalatória. No mínimo 65% de uma dose oral de formoterol foi absorvido a partir do trato gastrointestinal, embora 70% tenha sido submetido ao metabolismo pré-sistêmico. As concentrações plasmáticas de pico do medicamento inalterado ocorreram em 0,5 a 1 hora da administração oral. A ligação proteica plasmática de formoterol foi 61-64% com 34% de ligação com albumina. Não houve saturação de ligação na faixa de concentração atingida com doses terapêuticas. A meia-vida de eliminação determinada após a administração oral foi de 2-3 horas. A absorção de formoterol foi linear após a inalação de 12 a 96 mcg de fumarato de formoterol.
Metabolismo:
O formoterol é amplamente metabolizado e a via proeminente envolve conjugação direta no grupo hidroxila fenólico. O conjugado ácido glicuronídeo é inativo. A segunda principal via envolve a O-desmetilação seguida por conjugação no grupo 2’-hidroxila fenólico. Isoenzimas do Citocromo P450 CYP2D6, CYP2C19 e CYP2C9 estão envolvidas na O-desmetilação do formoterol. O fígado parece ser o local primário de metabolismo. O formoterol não inibe as enzimas CYP450 em concentrações terapeuticamente relevantes.
Excreção:
A excreção urinária cumulativa de formoterol após inalação única de um DPI (pó inalatório) aumentou linearmente na faixa de dose 12 – 96 mcg. Em média, 8% e 25% da dose foi excretada como formoterol inalterado e total, respectivamente. Com base nas concentrações plasmáticas medidas após a inalação de uma dose única de 120 mcg em 12 voluntários saudáveis, a meia-vida de eliminação terminal média foi determinada como sendo 10 horas. Os enantiômeros (R,R) e (S,S) representaram cerca de 40% e 60% do medicamento inalterado excretado na urina, respectivamente. A proporção relativa dos dois enantiômeros permaneceu constante na faixa de dose estudada e não houve evidência de acúmulo relativo de um enantiômero sobre o outro após a administração repetida. Após a administração oral (40 a 80 mcg), 6% a 10% da dose foi recuperada na urina como medicamento inalterado em sujeitos de pesquisa saudáveis; até 8% da dose foi recuperada como glicuronídeo. Um total de 67% de uma dose oral de formoterol é excretado na urina (principalmente como metabólitos) e o restante nas fezes. A depuração renal de formoterol é de 150 mL/min.
Populações especiais:
A farmacocinética de formoterol, até o momento, não foi estuda em pacientes com insuficiência renal e hepática.
Hipersensibilidade conhecida ao dipropionato de beclometasona, fumarato de formoterol e/ou quaisquer dos excipientes.
Pacientes com hipersensibilidade ao álcool não devem usar FOSTAIR® aerossol.
Este medicamento é contraindicado para menores de 18 anos.
FOSTAIR® deve ser usado com precaução e somente sob condições estritas de indicação em pacientes com arritmias cardíacas, especialmente bloqueio atrioventricular de terceiro grau e taquiarritmias, estenose subvalvular aórtica idiopática, cardiomiopatia hipertrófica obstrutiva, cardiomiopatia severa, especialmente infarto agudo do miocárdio, cardiopatia coronária, isquemia cardíaca, insuficiência cardíaca congestiva, doenças vasculares oclusivas, especialmente arteriosclerose, hipertensão arterial e aneurisma, hipertireoidismo, especialmente tireotoxicose, diabetes mellitus refratária, feocromocitoma e hipocalemia não tratável.
Como os corticosteroides podem apresentar propriedades imunossupressoras, é importante verificar com o paciente se ele recebeu vacina recentemente.
Deve haver precaução ao tratar pacientes com prolongamento do intervalo de QTc, p.ex., induzido pelo medicamento ou congênito (QTc > 0,44 segundos). Formoterol pode induzir o prolongamento do intervalo de QTc. FOSTAIR® pode ser usado somente com precauções especiais (p.ex. monitoria) em pacientes com arritmia taquicárdica (batimentos do coração acelerados e/ou irregulares).
Hipocalemia potencialmente grave pode resultar da terapia com agonista β-2. Precaução especial é aconselhada na asma severa uma vez que este efeito pode ser potencializado pela hipóxia e tratamento concomitante com outras drogas que podem induzir a hipocalemia, como os derivados das xantinas, esteroides e diuréticos. Também se recomenda ter precaução em caso de asma instável, quando vários broncodilatadores de resgate podem ser usados. É recomendado que os níveis de potássio sérico sejam monitorados em tais situações.
A inalação de altas doses de formoterol pode causar elevação dos níveis de glicemia. Esse parâmetro deve, por isso, ser atentamente monitorado em pacientes diabéticos.
Se a anestesia com anestésicos halogenados for planejada, FOSTAIR® não deve ser administrado por no mínimo 12 horas antes do início da anestesia por existir um risco de arritmias cardíacas.
Risco de morte relacionado à Asma: Pacientes com asma devem ser informados que formoterol, um dos princípios ativos presentes em FOSTAIR®, pode aumentar o risco de morte relacionado à asma.
Assim como com toda medicação inalada contendo corticosteroides, FOSTAIR® deve ser administrado com cuidado em pacientes com tuberculose pulmonar ativa ou quiescente, infecções fúngicas e virais das vias aéreas.
É recomendado que a descontinuação do tratamento com FOSTAIR® não seja feita abruptamente. Caso o paciente considere o tratamento ineficaz, deve-se buscar atenção médica. O manejo da asma deve normalmente seguir um programa gradual e a resposta do paciente deve ser monitorada clinicamente e por testes de função pulmonar. O uso crescente de broncodilatadores de resgate indica piora da condição clínica e requer uma reavaliação da terapia para asma. A deterioração súbita e progressiva do controle da asma representa uma ameaça à vida potencial e o paciente deve ser submetido a uma avaliação clínica urgente para modificação da terapia. Deve-se levar em consideração a necessidade de tratamento com corticosteróides, terapia oral ou inalatória ou tratamento com antibióticos, caso haja suspeita de infecção. Os pacientes não devem ser iniciados com FOSTAIR® durante uma exacerbação ou se tiverem um agravamento significativo ou uma deterioração aguda da asma. Podem ocorrer eventos adversos e exacerbações graves relacionados com asma durante o tratamento com FOSTAIR®. Os doentes devem ser solicitados a continuar o tratamento, mas devem procurar aconselhamento médico se os sintomas da asma permanecerem descontrolados ou se agravarem após o início do tratamento com FOSTAIR®.
Para o tratamento de ataques asmáticos agudos, os pacientes devem ser aconselhados a manter o broncodilatador de ação rápida sempre disponível, seja FOSTAIR® (para pacientes que usam FOSTAIR® como terapia de manutenção e alívio) ou um broncodilatador de ação rápida isolado (para pacientes que usam FOSTAIR® apenas como terapia de manutenção).
Os pacientes devem ser lembrados de administrar FOSTAIR® diariamente como prescrito, mesmo quando estiverem assintomáticos. As inalações de alívio de FOSTAIR® devem ser tomadas em resposta a sintomas de asma, mas não se destinam a uso profilático regular, por exemplo, antes do exercício. Para tal uso, um broncodilatador de ação rápida deve ser considerado.
Uma vez que os sintomas da asma estiverem controlados, deve ser considerada a diminuição gradual das doses de FOSTAIR®. A terapia não deve ser iniciada durante uma exacerbação.
Assim como com outras terapias de inalação, o broncoespasmo paradoxal pode ocorrer com aumento imediato da respiração ofegante após a administração. FOSTAIR® deve ser descontinuado imediatamente, o paciente deve ser avaliado e uma terapia alternativa instituída, se necessário.
FOSTAIR® não é destinado para tratamento inicial da asma.
Podem ocorrer efeitos sistêmicos com qualquer corticosteroide inalado, especialmente em alta dose prescrita por períodos longos. Esses efeitos têm probabilidade menor de ocorrência com corticosteroides inalados em comparação a orais. Possíveis efeitos sistêmicos incluem: Síndrome de Cushing, características da síndrome de Cushing, supressão adrenal, retardo do crescimento em crianças e adolescentes, redução da densidade mineral óssea, catarata e glaucoma e mais raramente uma variedade de efeitos psicológicos e comportamentais incluindo hiperatividade psicomotora, distúrbios do sono, ansiedade, depressão ou agressividade (particularmente em crianças). Portanto, é importante que o paciente seja avaliado regularmente e que a dose de corticosteroide inalado seja reduzida à dose mais baixa na qual o controle eficaz da asma seja mantido.
Dados farmacocinéticos de dose única demonstraram que o uso de FOSTAIR® aerossol com espaçador do tipo Aerochamber Plus® não aumentou a exposição sistêmica total ao dipropionato de beclometasona, e seu metabólito beclometasona-17-monopropionato, e nem ao formoterol em comparação com o uso de FOSTAIR® aerossol com o dispositivo de aplicação padrão (bocal em L). Portanto, não há risco aumentado de efeitos sistêmicos pelo uso de FOSTAIR® aerossol com o espaçador citado.
O tratamento prolongado de pacientes com doses altas de corticosteroides inalados pode resultar em supressão adrenal e crise adrenal aguda. Crianças menores de 16 anos utilizando doses maiores do que as recomendadas de dipropionato de beclometasona podem estar sob maior risco. Situações que podem desencadear a crise adrenal aguda incluem trauma, cirurgia, infecção severa ou qualquer redução rápida da dose. Os sintomas apresentados são tipicamente vagos e podem incluir anorexia, dor abdominal, perda de peso, cansaço, cefaleia, náusea, vômito, hipotensão, nível reduzido de consciência, hipoglicemia e ataques convulsivos. A cobertura adicional de corticosteroide sistêmico deve ser considerada durante períodos de estresse ou cirurgia eletiva.
Deve haver precaução na transferência de pacientes para a terapia com FOSTAIR®, especialmente se houver qualquer motivo para supor que a função adrenal está comprometida por conta da terapia sistêmica prévia com esteroides.
Pacientes em transição da terapia oral para corticosteroides inalados podem permanecer sob risco de insuficiência adrenal por um período de tempo considerável. Pacientes que exigiram terapia de emergência de altas doses de corticosteroides no passado também podem estar sob risco. Essa possibilidade de insuficiência residual deve sempre ser considerada em situações de emergência e eletivas, passíveis de produzir estresse, e um tratamento com corticosteroide adequado deve ser considerado. A extensão do comprometimento adrenal pode exigir conselho de especialistas antes da realização de procedimentos eletivos.
Os pacientes devem ser orientados a enxaguar a boca com água ou escovar os dentes após inalar a dose prescrita para minimizar o risco de infecção orofaríngea por cândida e disfonia.
FOSTAIR® (aerossol) contém uma pequena quantidade de álcool (etanol). Existe a possibilidade teórica de uma interação com dissulfiram ou metronidazol, em pessoas que são particularmente sensíveis ao tratamento com esses medicamentos.
Pneumonia em pacientes com DPOC: um aumento na incidência de pneumonia, incluindo pneumonia que requer hospitalização, tem sido observado em pacientes com DPOC que recebem corticosteróides inalatórios. Há evidência de um risco aumentado de pneumonia com o aumento da dose de esteróides, mas isso não foi demonstrado de forma conclusiva em todos os estudos. Não há evidências clínicas conclusivas para diferenças intraclasses na magnitude do risco de pneumonia entre os corticosteróides inalatórios. Os médicos devem ficar atentos quanto ao possível desenvolvimento de pneumonia em pacientes com DPOC, uma vez que as características clínicas dessa infecção se sobrepõem aos sintomas das exacerbações da DPOC. Os fatores de risco para pneumonia em pacientes com DPOC incluem tabagismo, idade avançada, baixo índice de massa corporal (IMC) e DPOC grave.
Distúrbio visual: distúrbios visuais podem ser relatados com o uso sistêmico e tópico de corticosteroides. Se algum paciente apresentar sintomas como visão turva ou outras alterações visuais, o paciente deve ser encaminhado a um oftalmologista para avaliação de possíveis causas que podem incluir catarata, glaucoma ou doenças raras, como a coriorretinopatia serosa central, que têm sido notificadas após o uso de corticosteroides sistêmicos e tópicos.
Efeitos sobre a capacidade de conduzir e utilizar máquinas:
É improvável que FOSTAIR® cause efeito sobre a capacidade de conduzir e operar máquinas.
Uso na gravidez:
Categoria C – Não foram realizados estudos em animais e nem em mulheres grávidas; ou então, os estudos em animais revelaram risco, mas não existem estudos disponíveis realizados em mulheres grávidas.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Fertilidade
Não há informações em humanos. Estudos em animais (ratos), a presença de dipropionato de beclometasona em doses altas na combinação foi associada com redução da fertilidade da fêmea e toxicidade do embrião.
Gravidez
Não existem dados clínicos relevantes a respeito do uso de FOSTAIR® durante a gravidez. Estudos em animais utilizando a combinação de dipropionato de beclometasona e formoterol mostrou evidências de toxicidade para a reprodução após a alta exposição sistêmica (ver item “Dados de segurança pré-clínica”). Altas doses de corticosteroides administrados em animais prenhes são conhecidas por causar anormalidades no desenvolvimento fetal incluindo fenda palatina e retardo do crescimento intrauterino. Por causa das ações tocolíticas dos agentes beta2-simpatomiméticos, cuidado especial deve ser exercido no período antecedente ao parto. Formoterol não deve ser recomendado para uso durante a gravidez e, particularmente no final da gravidez ou durante o parto, a menos que não haja alternativa estabelecida mais segura.
FOSTAIR® só deve ser usado durante a gravidez se os benefícios esperados superarem os riscos potenciais. A menor dose efetiva necessária para manter um controle adequado da asma deve ser utilizada no tratamento durante a gravidez.
Uso na Lactação
Não há dados clínicos relevantes relacionados ao uso de FOSTAIR® durante a lactação em humanos. Apesar de não haver informações disponíveis em experimentos com animais, é razoável assumir que o dipropionato de beclometasona seja secretado no leite, assim como outros corticosteroides.
Não se sabe se o formoterol passa para o leite materno, mas ele foi detectado no leite de animais em lactação. A administração de FOSTAIR® em mulheres que estão amamentando deve ser considerada se os benefícios esperados forem maiores do que os riscos potenciais do tratamento. A decisão deve ser feita entre interromper a amamentação ou descontinuar a terapia com FOSTAIR® levando em consideração o benefício da amamentação para a criança e o benefício do tratamento para a mãe.
Uso criterioso no aleitamento ou na doação de leite humano. O uso deste medicamento no período da lactação depende da avaliação e acompanhamento do médico ou cirurgião-dentista.
USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO
Uso em crianças:
FOSTAIR® não é recomendado para crianças.
Uso em idosos:
Não é necessário ajuste de dose para pacientes idosos.
Nota: FOSTAIR® não é apropriado para o tratamento de ataques asmáticos agudos.
Este medicamento é contraindicado para menores de 18 anos.
Esse medicamento pode causar resultado positivo em testes antidopagem em atletas. Consulte a Lista Proibida vigente, Código Mundial Antidopagem disponível no endereço eletrônico da Autoridade Brasileira de Controle de Dopagem para mais informações.
Este medicamento pode potencializar o prolongamento do intervalo QT, o que aumenta o risco de ataque de arritmias ventriculares graves do tipo "torsades de pointes", que é potencialmente fatal (morte súbita).
Este medicamento contém álcool (etanol) e pode causar intoxicação, especialmente em crianças.
Interações farmacocinéticas
O dipropionato de beclometasona é submetido a um metabolismo muito rápido via enzimas esterases.
A beclometasona é menos dependente do metabolismo do CYP3A do que alguns outros corticosteroides e, em geral, as interações são improváveis; entretanto, a possibilidade de efeitos sistêmicos com o uso concomitante de inibidores fortes do CYP3A (por exemplo, ritonavir, cobicistate) não pode ser excluída e, portanto, recomenda-se cautela e monitoramento apropriado com o uso de tais agentes.
Interações farmacodinâmicas
Βeta-bloqueadores (incluindo colírios) devem ser evitados por pacientes asmáticos. Caso sejam administrados por motivos maiores, o efeito do formoterol será reduzido ou extinto. Por outro lado, o uso concomitante de outros medicamentos β-adrenérgicos pode ter efeitos potencialmente aditivos, portanto é necessário ter cuidado quando teofilina ou outro β-adrenérgico for prescrito concomitantemente com formoterol. O tratamento concomitante com quinidina, disopiramida, procainamida, fenotiazinas, alguns anti-histamínicos (como a terfenadina), inibidores da monoaminoxidase e antidepressivos tricíclicos pode prolongar o intervalo de QTc e elevar o risco de arritmias ventriculares. Além disso, L-Dopa, L-tiroxina, oxitocina e álcool podem comprometer a tolerância cardíaca à β2 simpatomiméticos. O tratamento concomitante com inibidores da monoaminoxidase, incluindo agentes com propriedades semelhantes, como furazolidona e procarbazina, podem precipitar reações hipertensivas. Há um risco elevado de arritmia em pacientes recebendo anestesia concomitante com hidrocarbonetos halogenados. Tratamento concomitante com derivados da xantina, esteroides ou diuréticos podem potencializar um possível efeito de hipocalemia do β-2-agonista. A hipocalemia pode elevar a disposição à arritmia em pacientes tratados com glicosídeos digitálicos.
Há um potencial teórico de interação particularmente em pacientes sensíveis utilizando dissulfiram ou metronidazol, pois FOSTAIR® (aerossol) contém álcool e sua interação com dissulfiram pode causar vermelhidão e com metronidazol pode ocorrer vermelhidão, vômitos e taquicardia.
A validade do FOSTAIR® (aerossol) é de 17 meses.
Antes do paciente iniciar o uso: Armazenar em geladeira (entre 2°C e 8°C).
Após o paciente iniciar o uso: Armazenar em temperatura ambiente (15oC a 30oC). Após armazenagem em temperatura ambiente, válido por 2 meses.
Proteger do calor.
Atenção: no cartucho do medicamento, há um local para incluir a data do 1º uso e a data de validade em temperatura ambiente. A data de validade em temperatura ambiente não pode ser posterior à data de validade do lote (vide informação impressa na embalagem).
FOSTAIR® (aerossol) é uma lata pressurizada cujo jato, uma névoa incolor, tem leve odor e sabor alcoólico.
Importante: A lata de FOSTAIR® (aerossol) é pressurizada. Não tentar furá-la, quebrá-la ou queimá-la, mesmo quando vazia. O recipiente não deve ser exposto a fontes de calor.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido.
Para a sua segurança, mantenha o medicamento na embalagem original.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Para garantir a administração adequada do medicamento, o paciente deve ser orientado sobre como usar o dispositivo por um médico ou por outro profissional de saúde.
Modo de usar:
FOSTAIR® (aerossol) é fornecido em frasco de alumínio pressurizado acoplado a um dispositivo de plástico que contém uma tampa de proteção no bocal. Na parte de trás do dispositivo há um contador de dose que indica quantas doses do medicamento ainda estão disponíveis. Cada vez que o paciente acionar o inalador (apertar o frasco de alumínio), ele liberará uma dose e o contador diminuirá em uma unidade. O paciente deve tomar cuidado para não deixar seu inalador cair, uma vez que isso pode fazer com o contador de dose seja acionado.
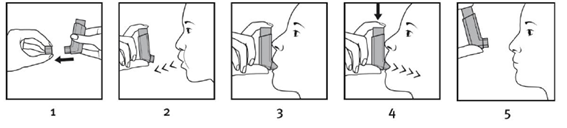
Testando o inalador:
Antes da primeira utilização do dispositivo e após um período de 14 dias ou mais sem utilizar, o paciente deve acionar o inalador no ar uma vez a fim de garantir o funcionamento sem falhas do dispositivo. Após testar o inalador pela primeira vez, o contador de dose deve mostrar 120.
Uso do Inalador:
Os pacientes devem ficar o mais próximo possível de uma posição ereta, seja sentado ou em pé, durante a inalação.
Para garantir a continuidade do tratamento, o paciente deve ser orientado a adquirir outra unidade quando o contador estiver aproximando-se do zero.
Importante: O paciente não deve fazer as etapas de 2 a 5 de maneira muito rápida.
Caso outra dose seja necessária, o paciente deve manter o dispositivo na posição vertical por cerca de trinta segundos e em seguida repetir as etapas 2 e 5.
Caso o paciente perceba que parte do medicamento tenha sido liberada pela parte superior do dispositivo ou pelo canto da boca, o procedimento de administração deve ser repetido a partir da etapa 2.
Para pacientes com dificuldade para segurar o dispositivo, pode ser mais fácil fazê-lo com as duas mãos. Portanto, a parte superior do dispositivo será segurada com os dois dedos indicadores e sua parte inferior com os dedos polegares.
Os pacientes devem enxaguar a boca com água após a inalação (vide advertências).
Se o paciente apresentar dificuldade para sincronizar o acionamento do dispositivo com a inspiração, ele poderá fazer uso de espaçador do tipo AeroChamber Plus®. Neste caso, o paciente deve ser orientado sobre o correto uso do dispositivo com espaçador, e a técnica utilizada pelo paciente deve ser conferida pelo médico ou farmacêutico para garantir a correta deposição do medicamento no pulmão.
Posologia
FOSTAIR® não é indicado para o tratamento inicial da asma. A administração dos componentes é individual e deve ser ajustada à severidade da doença. Isso deve ser considerado não apenas quando o tratamento com associação fixa é iniciado, mas também quando a dose é ajustada. Caso um paciente exija uma combinação de doses diferente da combinação disponível no dispositivo, doses adequadas de agonista β-2 e/ou corticosteroides através de dispositivos individuais devem ser prescritas.
Em relação à duração do tratamento, o profissional da saúde deve avaliar cada caso.
Dipropionato de beclometasona em FOSTAIR® é caracterizado por uma distribuição de partículas extrafinas a qual resulta em um efeito mais potente do que o efeito de formulações de dipropionato de beclometasona com distribuição de partículas não extrafinas (100 mcg de dipropionato de beclometasona extrafina de FOSTAIR® podem ser comparados a 250 mcg de dipropionato de beclometasona de formulações não extrafinas). Portanto a dose diária total de dipropionato de beclometasona administrada com FOSTAIR® é menor que a dose diária total de dipropionato de beclometasona de uma formulação não extrafina.
Isto deve ser levado em consideração quando um paciente transferir o tratamento de uma formulação não extrafina de dipropionato de beclometasona para FOSTAIR®; a dose de dipropionato de beclometasona deve ser menor e necessitará ser ajustada de acordo com a necessidade do paciente.
Doses Recomendadas:
FOSTAIR® deve somente ser utilizado por via inalatória (oral)
Uso adulto
ASMA:
Há duas opções de tratamento:
A-Terapia de manutenção:
FOSTAIR® é utilizado como um tratamento de manutenção regular com um broncodilatador de curta ação isolado, quando necessário.
Os pacientes devem ser orientados para terem seu broncodilatador de curta ação isolado disponível para o uso de resgate a qualquer hora.
Dose recomendada para adultos com mais de 18 anos:
Recomenda-se utilizar 1 a 2 inalações, a cada 12 horas (duas vezes ao dia).
A dose máxima diária para tratamento de manutenção é de 4 inalações.
B-Terapia de manutenção e alívio:
FOSTAIR® é utilizado como um tratamento de manutenção regular e em resposta aos sintomas da asma, quando necessário.
Pacientes utilizando sua dose diária de manutenção de FOSTAIR® e adicionalmente utilizando FOSTAIR® em resposta aos sintomas da asma quando necessário. Os pacientes devem ser orientados para sempre terem FOSTAIR® disponível para o uso de resgate.
FOSTAIR® como terapia de manutenção e alívio deve ser especialmente considerado para pacientes com:
O monitoramento cuidadoso para a detecção de eventos adversos relacionados à dose é requerido em pacientes que frequentemente utilizam um número alto de doses de FOSTAIR® quando necessário.
Dose recomendada para adultos com mais de 18 anos:
Recomenda-se utilizar 1 inalação, a cada 12 horas (duas vezes ao dia), como terapia de manutenção.
Pacientes podem administrar 1 inalação adicional, se necessário, em resposta aos sintomas. Caso os sintomas persistam após alguns minutos, mais 1 inalação adicional pode ser realizada.
A dose máxima diária para tratamento de manutenção e alívio é de 8 inalações.
Pacientes requerendo mais de 8 inalações ao dia devem ser fortemente orientados a consultar o médico. A asma deve ser reavaliada e a terapia de manutenção deve ser reconsiderada.
DPOC: Recomenda-se utilizar 2 inalações, a cada 12 horas (duas vezes ao dia).
A dose máxima diária é de 4 inalações.
Uma vez que FOSTAIR® contém dipropionato de beclometasona e fumarato de formoterol, o tipo e severidade das reações adversas associadas a cada composto podem ser previstos. Não há incidência de eventos adversos adicionais após a administração concomitante dos dois compostos.
Reações adversas reportadas durante os estudos clínicos e experiência clínica com FOSTAIR® (aerossol):
Reação muito comum (> 1/10): Não foram relatadas reações muito comuns até o momento.
Reação comum (> 1/100 e < 1/10): faringite, candidíase oral, pneumonia (em pacientes com DPOC), cefaleia, disfonia.
Reação incomum (> 1/1.000 e < 1/10): gripe, infecção fúngica oral, candidíase orofaríngea e esofágica, candidíase vulvovaginal, gastroenterite, sinusite, rinite, granulocitopenia, dermatite alérgica, hipocalemia, hiperglicemina, inquietação, tremor, tontura, otite, palpitações, prolongamento do intervalo QT corrigido em eletrocardiograma, taquicardia, taquiarritmia, alteração em eletrocardiograma, fibrilação atrial, hiperemia, rubor, tosse, tosse produtiva, irritação na garganta, crise asmática, diarreia, boca seca, dispepsia, disfagia, sensação de queimação nos lábios, náusea, disgeusia, prurido, rash e hiperidose, urticária, cãibra muscular, mialgia, proteína C-reativa elevada, contagem de plaquetas elevada, aumento de ácido graxos livres, aumento na insulina sanguínea, aumento de corpos cetônicos sanguíneos, diminuição do cortisol sanguíneo.
Reação rara (> 1/10.000 e < 1/1.000): extrassístole ventricular, angina pectoris, broncoespasmo paradoxal, angioedema, nefrite, aumento na pressão sanguínea, diminuição da pressão sanguínea.
Reação muito rara (< 1/10.000): trombocitopenia, reações de hipersensibilidade, incluindo eritema, edema nos lábios, face, olhos e faringe, supressão adrenal, catarata, glaucoma, dispneia, exacerbação da asma, retardo no crescimento em crianças e adolescentes, edema periférico, diminuição da densidade óssea.
Reação cuja frequência é desconhecida: hiperatividade psicomotora, distúrbios do sono, ansiedade, depressão, agressividade, mudanças comportamentais (predominantemente em crianças), visão turva.
Reações adversas típicas associadas ao uso de formoterol:
Dentre as reações adversas observadas, aquelas tipicamente associadas ao formoterol são: hipocalemia, tremor, cefaleia, palpitações, tosse, cãibra muscular, taquicardia, bradicardia sinusal, angina pectoris, isquemia do miocárdio, prolongação do intervalo QT.
Reações adversas típicas associadas ao uso de beclometasona:
As reações adversas tipicamente associadas à administração de dipropionato de beclometasona são: infecção fúngica oral, candidíase oral, disfonia, irritação da garganta, diminuição da concentração sanguínea de cortisol, aumento da glicemia. Distúrbio de paladar tem sido ocasionalmente reportado durante a terapia com corticoide inalatório.
Assim como ocorre com outros corticosteroides inalatórios, podem ocorrer efeitos sistêmicos, especialmente em alta dose prescrita por períodos longos. Esses efeitos têm probabilidade menor de ocorrência com corticosteroides inalados em comparação a orais. Possíveis efeitos sistêmicos incluem: Síndrome de Cushing, características da síndrome de Cushing, supressão adrenal, retardo do crescimento em crianças e adolescentes, redução da densidade mineral óssea, catarata e glaucoma e mais raramente uma variedade de efeitos psicológicos e comportamentais incluindo hiperatividade psicomotora, distúrbios do sono, ansiedade, depressão ou agressividade (particularmente em crianças).
Reações de hipersensibilidade incluindo erupção cutânea, urticária, prurido, eritema e edema de olhos, face, lábios e garganta (angioedema) têm sido reportadas.
Assim como ocorre com outras terapêuticas inalatórias, pode ocorrer broncoespasmos paradoxais com imediato aumento na ronquidão, tosse e falta de ar após a administração do medicamento.
Todas as reações adversas descritas acima podem ocorrer durante o uso de FOSTAIR® aerossol. Caso o paciente apresente algumas destas reações ou qualquer outra reação não descrita, notifique pelo Sistema VigiMed, disponível no Portal da ANVISA.
A maior dose recomendada de FOSTAIR® em uma administração única é de 2 inalações. Quatro inalações cumulativas de FOSTAIR® (total de 400 mcg dipropionato de beclometasona e 24 mcg formoterol administrados como uma única dose) foram estudadas em pacientes asmáticos. O tratamento cumulativo não causou efeitos anormais clinicamente relevantes nos sinais vitais e também não foram observados eventos adversos sérios.
Doses inaladas de FOSTAIR® até doze acionamentos cumulativos (total de dipropionato de beclometasona de 1.200 microgramas, formoterol 72 microgramas) foram estudadas em pacientes asmáticos. Os tratamentos cumulativos não causaram efeito anormal nos sinais vitais e eventos adversos sérios ou graves não foram observados.
Doses excessivas de formoterol podem resultar em efeitos típicos de agonistas β-2-adrenérgicos: náusea, vômito, cefaleia, tremor, sonolência, palpitações, taquicardia, arritmias ventriculares, prolongação do intervalo QTc, acidose metabólica, hipocalemia, hiperglicemia.
Em caso de superdose de formoterol, é indicado tratamento sintomático e de suporte. Casos graves devem ser internados. O uso de bloqueadores β-adrenérgicos cardiosseletivos pode ser considerado, mas com extrema precaução, uma vez que o uso de medicação bloqueadora β-adrenérgica pode provocar broncoespasmo. O potássio sérico deve ser monitorado.
A inalação aguda de doses em excesso de dipropionato de beclometasona pode resultar em supressão temporária da função adrenal. Não é necessária ação emergencial uma vez que a função adrenal se recupera em poucos dias, como verificado por medidas de cortisol plasmático. Nestes pacientes o tratamento deve ser mantido em dose suficiente para controlar a asma. Sobre a superdose crônica de dipropionato de beclometasona inalada, ver o item precaução (risco de supressão adrenal). Pode ser necessária monitoria da reserva adrenal.
Doses supraterapêutica simples de até 800 mcg de dipropionato de beclometasona e 48 mcg de fumarato de formoterol são geralmente seguras e bem toleradas.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder.
DIZERES LEGAIS:
Registro: 1.0058.0114
Registrado e Importado por:
Chiesi Farmacêutica Ltda.
Rua Dr. Giacomo Chiesi nº 151 - Estrada dos Romeiros km 39,2
Santana de Parnaíba - S.P.
CNPJ n° 61.363.032/0001-46 - ® Marca Registrada
SAC (Serviço de Atendimento ao Consumidor): 0800 1104525
Produzido por: Chiesi Farmaceutici S.p.A - Parma - Itália
Embalado (embalagem secundária) por: Chiesi Farmaceutici S.p.A - Parma - Itália ou Chiesi Farmacêutica Ltda. - Santana de Parnaíba - S.P.
Venda sob prescrição
Esta bula foi aprovada pela Anvisa em 06/01/2025.
FOSTAIR 100_SOL_AER_100580114_VPS15